授業力をみがく
新学習指導要領で生まれ変わった「化学変化とイオン」(2)
北海道教育大学教授
田口 哲
前回述べた通り,令和3年度全面実施の新中学校学習指導要領では,「化学変化とイオン」は大きく改訂され,高校化学で学習してきた「ダニエル電池」が中学校でも扱われることになりました。ダニエル電池(図1)は,負極として硫酸亜鉛水溶液の中に亜鉛板が,正極として硫酸銅水溶液の中に銅板が浸漬されており,硫酸亜鉛水溶液と硫酸銅水溶液の間は隔膜(セロハンなど)で仕切られています。
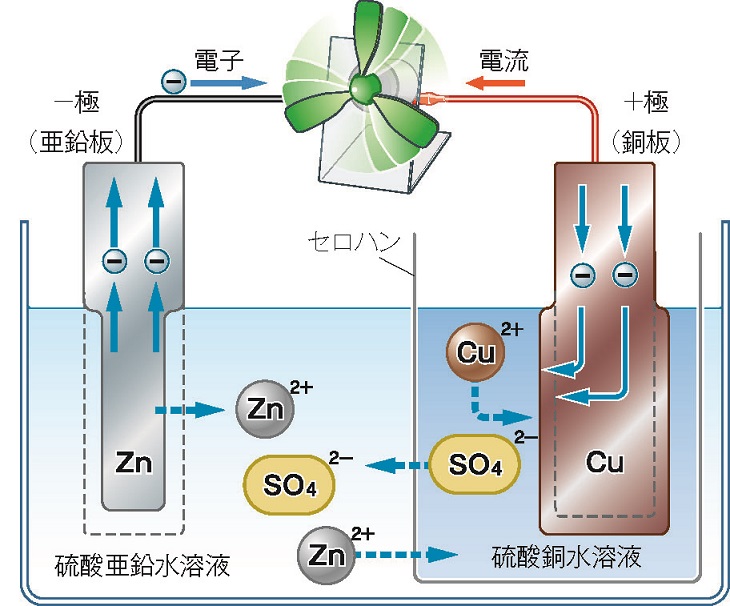
ダニエル電池
中学校では,まず,金属の違いによるイオンへのなりやすさの違いを探究し,その結果をもとに,化学電池における電極間の電子移動の仕組みの理解へと繋げると良いでしょう。3種類程度の金属片(例えば,銅,亜鉛,マグネシウム)を用いて,これら金属のイオンを含む溶液(例:硫酸銅,硫酸亜鉛,硫酸マグネシウムの各水溶液)にこれら金属片を各々浸してみて,表面に金属が析出するかを調べます。例えば,硫酸銅水溶液の中に亜鉛板を入れると,ZnがZn^2+として溶け出し,残ったZn由来の電子2個を硫酸銅水溶液中のCu^2+が受け取って亜鉛板にCuが析出しますが,硫酸亜鉛水溶液の中に銅板を入れてもZnは析出しません。すなわち,亜鉛と銅を比較すると,亜鉛の方が銅よりもイオンになりやすいことがわかります(「イオン化傾向」は銅よりも亜鉛の方が大きい)。
ダニエル電池の放電における正極・負極の化学反応は以下の通りです。

ダニエル電池では,負極の亜鉛は電子を失って亜鉛イオンとなり,正極では,導線を通って負極から移動してきた電子を銅イオンが受け取って銅原子になる反応が進むと考察できます。次回(最終回)は,ダニエル電池を中学校理科で扱う際の留意点について解説します。
------------------------------------------------------------
田口 哲 先生
1968年北海道生まれ。北海道教育大学卒業。北海道大学大学院理学研究科修士課程・同大学院地球環境科学研究科博士課程修了。博士(地球環境科学)。北海道教育大学講師,准教授を経て2011年教授,2019年から札幌校キャンパス長。専門は物理化学,化学教育。1999〜2001年大学入試センター教科専門委員会委員,2006〜2011年大学入試センター教科科目第2委員会委員。化学教育ジャーナル(CEJ)編集委員。著書「理科教育学−教師とこれから教師になる人のために−」(東京教学社)「解説実験書 新しい北海道の理科」(北海道教育大学)。電気化学・物理化学に関する論文,化学教育に関する論文等多数。
アンケート
よろしければ記事についてのご意見をお聞かせください。
Q1またはQ3のいずれか一方はご入力ください。

