授業のワンポイント
化学変化と物質の質量
■うすい塩酸とうすい水酸化バリウム水溶液の反応による質量の変化
図61の図示実験で、沈殿ができる反応では、反応の前後で物質全体の質量が変化しないことを確認させます。
手順としては、まず2.5%硫酸20cm^3と2.5%水酸化バリウム水溶液20cm^3を準備し、いずれも、電子てんびんで合計質量を測定します。その後、2つの水溶液を混合し、沈殿を発生させます。沈殿ができた後の合計質量を測定し、前後の質量を比較します。
実験の際、水酸化バリウムと硫酸の取り扱いには、じゅうぶん注意させます。特に、水酸化バリウムは強いアルカリ性を示すため、絶対に目に入らないように保護眼鏡を必ず装着させましょう。
■化学変化の前後の物質全体の質量
教科書p.189の章導入写真や図59の実験、p.190の図61の図示実験などを振り返りながら、化学変化の前後での質量の変化には気体の出入りがかかわっていることを見いださせます。
探Q実験6は、気体の発生する化学変化では、密閉容器内で反応させた際に、反応の前後で物質全体の質量は変化しないことを見いださせます。気体の出入りがかかわっている化学変化でも質量が保存されることを証明する方法を考えるという課題を明確にしましょう。
<実験の例>
炭酸水素ナトリウム1gを容器の底に、5%塩酸10cm^3を内容器に入れ、ふたをしっかり閉めます。これを怠ると、気体が逃げるため、反応の前後で物質全体の質量が変化してしまいます。また、未反応の塩酸がもれる可能性もあり、大変危険です。
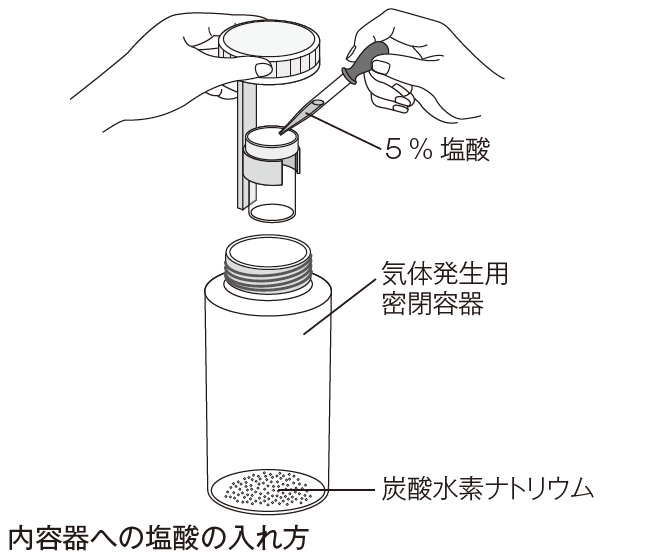
内容器への塩酸の入れ方
塩酸を炭酸水素ナトリウムと反応させ、その粉末が全て溶け、気体の発生がおさまるのを待ってから、質量を測定します。続いて、ふたを緩め、気体が抜ける音によって、気体が逃げたことを確かめます。また、容器の口にポリエチレンの袋等をかぶせることで、気体が出ていくことを視覚的にも確認させることができます。
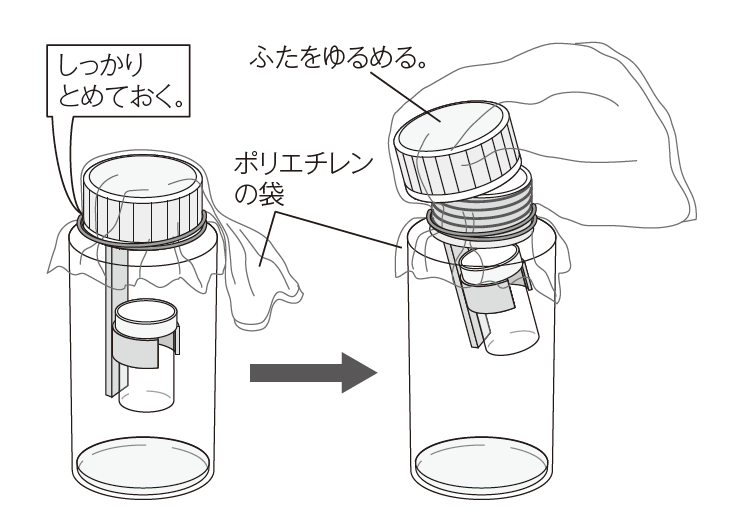
ふたの緩め方
■金属と酸素が結びつくときの、金属と酸素の質量
金属を空気中で加熱すると、結びつく酸素の分だけ質量がふえますが、その後は何回加熱しても質量がそれ以上ふえなくなることを、この実験により気づかせます。また、金属が酸素と結びつく際、金属と酸素の質量の比が一定になることを見いださせるのも目的です。
銅またはマグネシウムのどちらかを選択し、金属の質量は班ごとに変えて実験を行います。
<銅の粉末を加熱する場合>
1.00gの銅に対して加熱を繰り返します。この試料をステンレス皿に薄く広げ、皿を含めた全体の質量を、電子てんびんで測ります。それから強い火で皿ごと金属を10分加熱し、火を止めます。じゅうぶん冷めてから、皿全体の質量を測ります。以降、この手順を繰り返し、質量を記録します。
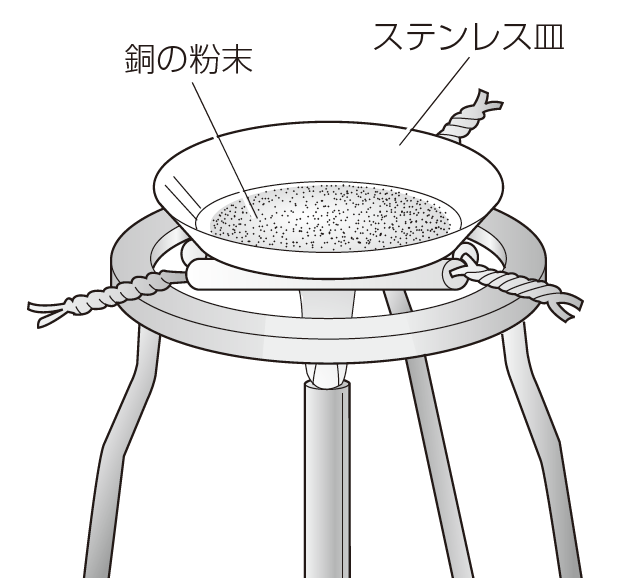
実験の様子
<けずり状のマグネシウムを加熱する場合>
以下の点に注意し、事前に指導しておきましょう。
・マグネシウムが発火すると強い光を発するので、凝視しない。
・湿ったマグネシウム粉を使用すると、反応中に水素が発生して爆発する可能性がある。
・生成物の酸化マグネシウムは塩基性酸化物のため、空気中の水や二酸化炭素と反応する。従って、やけどに注意しながら、できるだけ速やかに質量の測定を行う。
[物質]化学変化と原子・分子
4章 化学変化と物質の質量(教科書p.189〜199)
アンケート
よろしければ記事についてのご意見をお聞かせください。
Q1またはQ3のいずれか一方はご入力ください。

